Đề cương ôn tập học kì II môn Hóa học 8 - Năm học 2019-2020 - Trường THCS Trần Văn Ơn
Bạn đang xem tài liệu "Đề cương ôn tập học kì II môn Hóa học 8 - Năm học 2019-2020 - Trường THCS Trần Văn Ơn", để tải tài liệu gốc về máy hãy click vào nút Download ở trên.
Tóm tắt nội dung tài liệu: Đề cương ôn tập học kì II môn Hóa học 8 - Năm học 2019-2020 - Trường THCS Trần Văn Ơn
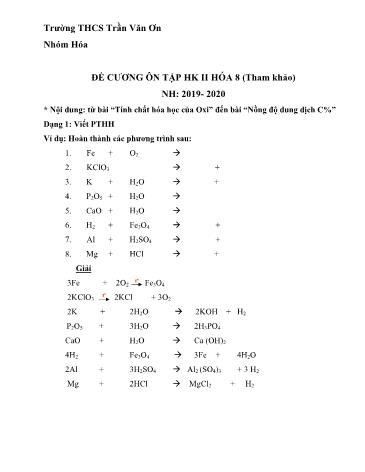
Trường THCS Trần Văn Ơn Nhóm Hóa ĐỀ CƯƠNG ÔN TẬP HK II HÓA 8 (Tham khảo) NH: 2019- 2020 * Nội dung: từ bài “Tính chất hóa học của Oxi” đến bài “Nồng độ dung dịch C%” Dạng 1: Viết PTHH Ví dụ: Hoàn thành các phương trình sau: 1. Fe + O2 → 2. KClO3 → + 3. K + H2O → + 4. P2O5 + H2O → 5. CaO + H2O → 6. H2 + Fe3O4 → + 7. Al + H2SO4 → + 8. Mg + HCl → + Giải tº 3Fe + 2O2 Fe3O4 tº 2KClO3 2KCl + 3O2 2K + 2H2O → 2KOH + H2 P2O5 + 3H2O → 2H3PO4 CaO + H2O → Ca (OH)2 4H2 + Fe3O4 → 3Fe + 4H2O 2Al + 3H2SO4 → Al2 (SO4)3 + 3 H2 Mg + 2HCl → MgCl2 + H2 Dạng 4: Nồng độ phần trăm của dung dịch Ví dụ: Tính khối lượng nước cần dùng để hòa tan 50g NaCl tạo thành dung dịch 10%. Giải Khối lượng dung dịch NaCl pha chế được: 50 = 푡 × 100% = × 100% = 500 푙 % 10% Khối lượng nước cần dùng hòa tan 50g NaCl là m H2O= mdd - mct = 500 – 50 = 450g Dạng 5: Toán tính theo PTHH * Dạng 1: Toán 2 PTHH liên tiếp Cho Fe tác dụng hoàn toàn với dung dịch có chứa 14,6g HCl. Dẫn khí thu được qua bột CuO đun nóng thu được chất rắn A. a. Viết PTHH? b. Tính khối lượng Fe tham gia phản ứng? c. Tính khối lượng rắn A? d. Tính thể tích khí hidro tạo thành (đkc)? Giải a. Fe + 2HCl FeCl2 + H2 1 : 2 : 1 : 1 (mol) 0,2 : 0,4 : 0,2 : 0,2 (mol) tº H2 + CuO Cu + H2O 1 : 1 : 1 : 1 (mol) 0,2 : 0,2 : 0,2 : 0,2 (mol) b. PTK của HCl= 1 + 35,5 =36,5 đvC → MHCl = 36,5 (g/mol) Số mol của HCl là Lập tỉ lệ : , , < => HCl dư → Tính theo nFe Các chất sau phản ứng: FeCl2; H2 và HCl dư Số mol HCl dư nHCl dư = 0,3 - 0,2 = 0,1 (mol) Khối lượng HCl dư mHCl dư = n.M = 0,1. 36,5 = 3,65 g Khối lượng FeCl2: mFeCl2 = n × M = 0,1 × 127 = 12,7 (g) Khối lượng H2: m 2 = n × M = 0,1 × 2 = 0,2 (g) Thể tích H2 (đkc) VH2 = n × 22,4 = 0,1 × 22,4 = 2,24 (lít)
File đính kèm:
 de_cuong_on_tap_hoc_ki_ii_mon_hoa_hoc_8_nam_hoc_2019_2020_tr.pdf
de_cuong_on_tap_hoc_ki_ii_mon_hoa_hoc_8_nam_hoc_2019_2020_tr.pdf