Đề kiểm tra cuối học kì II Hóa học 8 - Năm học 2022-2023 - Trường THCS Trường Sơn (Có đáp án + Ma trận)
Bạn đang xem tài liệu "Đề kiểm tra cuối học kì II Hóa học 8 - Năm học 2022-2023 - Trường THCS Trường Sơn (Có đáp án + Ma trận)", để tải tài liệu gốc về máy hãy click vào nút Download ở trên.
Tóm tắt nội dung tài liệu: Đề kiểm tra cuối học kì II Hóa học 8 - Năm học 2022-2023 - Trường THCS Trường Sơn (Có đáp án + Ma trận)
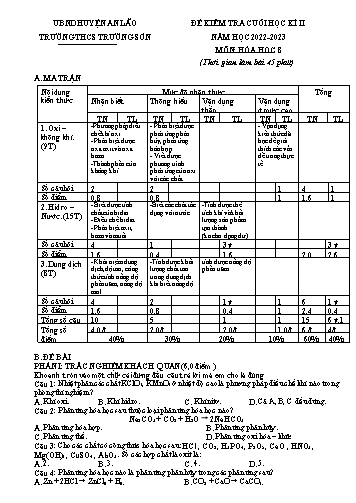
UBND HUYỆN AN LÃO ĐỀ KIỂM TRA CUỐI HỌC KÌ II TRƯỜNG THCS TRƯỜNG SƠN NĂM HỌC 2022-2023 MÔN: HÓA HOC 8 (Thời gian làm bài 45 phút) A. MA TRẬN Nội dung Mức độ nhận thức Tổng kiến thức Nhận biết Thông hiểu Vận dụng Vận dụng thấp ở mức cao TN TL TN TL TN TL TN TL TN TL 1. Oxi – -Phương pháp điều - Phân biệt được - Vận dụng không khí. chế khí oxi. phản ứng phân kiến thức đã (9T) - Phân biệt được hủy, phản ứng học để giải oxit axit và oxit hóa hợp. thích các vấn bazơ. - Viết được đề trong thực -Thành phần của phương trình tế. không khí. phản ứng của oxi với các chất. Số câu hỏi 2 2 1 4 1 Số điểm 0,8 0,8 1 1,6 1 2. Hidro – - Biết được tính -Biết các chất tác -Tính được thể Nước. (15T) chất của hidro. dụng với nước. tích khí và khối - Điều chế hidro. lượng sản phẩm - Phân biệt axit, tạo thành. bazơ và muối (ko cho dạng dư) Số câu hỏi 4 1 3 ý 3 ý Số điểm 1,6 0,4 1,6 2,0 2,6 3. Dung dịch - Khái niệm dung -Tính được khối tính được nồng độ (8T) dịch, độ tan, công lượng chất tan phần trăm. thức tính nồng độ trong dung dịch phần trăm, nồng độ khi biết nồng độ. mol. Số câu hỏi 4 2 1 ý 1 6 1 ý Số điểm 1,6 0,8 0,4 1 2,4 0,4 Tổng số câu 10 5 1 1 15 6 ý,1 Tổng số 4,0 đ 2,0đ 2,0đ 1,0đ 6 đ 4đ điểm 40% 30% 20% 10% 60% 40% B. ĐỀ BÀI PHẦN I: TRẮC NGHIỆM KHÁCH QUAN (6,0 điểm ) Khoanh tròn vào một chữ cái đứng đầu câu trả lời mà em cho là đúng Câu 1: Nhiệt phân các chất KClO3, KMnO4 ở nhiệt độ cao là phương pháp điều chế khí nào trong phòng thí nghiệm? A. Khí oxi.B. Khí hidro.C. Khí nitơ.D. Cả A, B, C đều đúng. Câu 2: Phản ứng hóa học sau thuộc loại phản ứng hóa học nào? Na2CO3 + CO2 + H2O 2NaHCO3 A. Phản ứng hóa hợp.B. Phản ứng phân hủy. C. Phản ứng thế.D. Phản ứng oxi hóa – khử. Câu 3: Cho các chất có công thức hóa học sau: HCl , CO2 , H3PO4 , P2O5 , CaO , HNO3 , Mg(OH)2 , CuSO4 , Al2O3. Số các hợp chất là oxit là: A. 2.B. 3.C. 4.D. 5. Câu 4: Phản ứng hóa học nào là phản ứng phân hủy trong các phản ứng sau? A. Zn + 2HCl ZnCl2 + H2. B. CO2 + CaO CaCO3. C. NaOH + HCl NaCl + H2O.D. 2NaHCO 3 Na2CO3 + CO2+H2O. Câu 5: Khí nào nhẹ nhất trong các chất khí sau: A. O2. B. H2. C. CO2. D. N2. Câu 6: Trong các chất sau: Na, P2O5, CaO, Na2O. Nước tác dụng được với chất nào tạo ra axit? A. Na.B. Na 2O.C. CaO.D. P 2O5. Câu 7: H2 KHÔNG tác dụng được với dãy chất nào ? A. Fe2O3 ; O2 ; CuO B. CuO; Fe2O3; O2 ; PbO C. MgO ; CuO; O2 ; SO2 D. Fe2O3; Fe3O4; O2 Câu 8: Trong phòng thí nghiệm người ta điều chế khí Hiđro bằng cách: A/ Điện phân nước C/ Sản xuất từ khí tự nhiên, khí dầu mỏ. B/ Nhiệt phân KMnO4 D/ Cho axit (HCl; H2SO4 loãng) tác dụng với kim loại (Zn; Fe ) Câu 9. Cho các chất sau: CuO, H2SO4, Ca(OH)2, KNO3, các chất được phân loại theo thứ tự: A) Axit, bazơ, muối, oxit B) Oxit, axit, bazơ, muối C) Bazơ, oxit, axit, muối D) Muối, axit, ba zơ, oxit. Câu 10: Công thức tính nồng độ phần trăm của dung dịch là: m .m m m .m m m A. C% ct dd B. C% ct .100% C. C% ct nuoc D. C% ct dd 100% mdd 100% 100% 0 Câu 11: Ở 20 C, hòa tan 20,7g CuSO4 vào 100g nước thì được một dung dịch CuSO4 bão hòA. 0 Vậy độ tan của CuSO4 trong nước ở 20 C là: A. 20g.B. 20,7g.C. 100g.D. 120,7g. Câu 12: Hòa tan hoàn toàn 10g đường vào 190g nước thì thu được dung dịch nước đường có nồng độ bằng A. 5,26%.B.10%.C. 5,0%.D. 20%. Câu 13: Công thức tính nồng độ mol của dung dịch là: n V A. B. C. D. CM CM CM n.V CM n V V n Câu 14: Độ tan của một chất là A. Số gam chất đó tan trong 100g dung dịch. B. Số gam chất đó tan trong 100 g nước. C. Số mol chất đó tan trong 1 lít dung dịch. D. Số gam chất đó tan trong 1 lít dung dịch. Câu 15: Dung dịch là hỗn hợp A. đồng nhất của dung môi và chất tan. B. của hai chất lỏng. C. của nước và chất lỏng.D. của chất rắn trong chất lỏng. PHẦN II: TỰ LUẬN (4,0 điểm) Câu 1 (1,0 điểm). Lập phương trình hóa học cho các sơ đồ phản ứng sau: 1, H2 + H2O 2, CuO + H2 + H2O 3, Na + H2O + H2 4, CO2 + H2O 5, Na2O + NaOH Câu 2 (2,0 điểm). Cho 4,6 gam kim loại natri tác dụng hết với 200 g nước. 1. Viết phương trình phản ứng xảy ra. 2. Tính thể tích khí H2 thu được (ở đktc) 3. Tính khối lượng bazơ tạo thành sau phản ứng. 4. Tính nồng độ phần trăm của dung dịch bazơ thu được sau phản ứng. Câu 3 (1 điểm). So sánh hiện tượng xảy ra khi đốt cháy lưu huỳnh trong không khí và trong bình oxy? Giải thích? (Cho Na = 23, Fe =56, Zn = 65, Mg = 24, Cu = 64, H =1, O=16) C. HƯỚNG DẪN CHẤM PHẦN I: TRẮC NGHIỆM (6,0 điểm) Mỗi ý đúng được 0,4 điểm Câu 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 Đáp án A A B D B D C D B B B C A B A PHẦN II: TỰ LUẬN (4,0 điểm) Câu Hướng dẫn chấm Điểm Câu 1 Mỗi phương trình đúng được 0,4 điểm (1,0 điểm) 1, 2H2 + O2 → 2H2O 0,2 điểm 2, CuO + H2 → Cu + H2O 0,2 điểm 3, 2Na + 2H2O → 2NaOH + H2 0,2 điểm 4, CO2 + H2O → H2CO3 0,2 điểm 5, Na2O + H2O → 2NaOH 0,2 điểm Câu 2 m 4,6 0,4 điểm 1. Số mol Na tham gia phản ứng là: n 0,2(mol) (2,0 điểm) Na M 23 PT: 2Na + 2H2O 2NaOH + H2 0,4 điểm Theo PT: 2 mol 2 mol 2mol 1 mol Theo ĐB: 0,2 mol 0,2 mol 0,2 mol 0,1 mol Vậy ta có: n 0,1(mol) H2 2. Vậy thể tích khí H2 thu được ở đktc: 0,4 điểm V n.22,4 0,1.22,4 2,24(lit) H2 3. Theo PT: n n 0,2(mol) NaOH Na 0,4 điểm Vậy khối lượng của NaOH: mNaOH n.M 0,2.40 8(gam) 4. Khối lượng dung dịch thu được sau phản ứng: mdd = mnước + mNa - mkhí hidro = 200 + 6,9 – 0,3 = 206,6 (gam) 0,4 điểm Nồng độ phần trăm của dung dịch sau phản ứng là: 12 C% .100% 5,808% 206,6 Câu 3 Giống: đều là sự đốt cháy lưu huỳnh, cho ngọn lửa màu xanh 0,4 (1 điểm) lam và có khí SO2 thoát ra. Khác: - Lưu huỳnh cháy trong không khí cho ngọn lửa nhỏ, màu 0,2 xanh nhạt mờ. - Lưu huỳnh cháy trong bình khí oxy cho ngọn lửa lớn, ánh sáng xanh đậm và có khói trắng. 0,2 Nguyên nhân: do cháy trong bình oxi có hàm lượng oxi lớn hơn, làm sự cháy diễn ra mãnh liệt hơn so với ngoài không khí. 0,2
File đính kèm:
 de_kiem_tra_cuoi_hoc_ki_ii_hoa_hoc_8_nam_hoc_2022_2023_truon.docx
de_kiem_tra_cuoi_hoc_ki_ii_hoa_hoc_8_nam_hoc_2022_2023_truon.docx