Đề kiểm tra giữa học kì I Hóa học 9 - Năm học 2022-2023 - Trường THCS Trường Sơn (Có đáp án + Ma trận)
Bạn đang xem tài liệu "Đề kiểm tra giữa học kì I Hóa học 9 - Năm học 2022-2023 - Trường THCS Trường Sơn (Có đáp án + Ma trận)", để tải tài liệu gốc về máy hãy click vào nút Download ở trên.
Tóm tắt nội dung tài liệu: Đề kiểm tra giữa học kì I Hóa học 9 - Năm học 2022-2023 - Trường THCS Trường Sơn (Có đáp án + Ma trận)
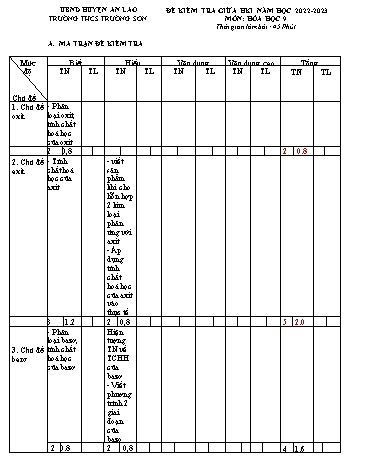
UBND HUYỆN AN LÃO ĐỀ KIỂM TRA GIỮA HKI NĂM HỌC 2022-2023 TRƯỜNG THCS TRƯỜNG SƠN MÔN: HÓA HỌC 9 Thời gian làm bài : 45 Phút A. MA TRẬN ĐỀ KIỂM TRA Mức Biết Hiểu Vận dụng Vận dụng cao Tổng độ TN TL TN TL TN TL TN TL TN TL Chủ đề 1. Chủ đề - Phân oxit loại oxit, tính chất hoá học của oxit 2 0,8 2 0.8 2. Chủ đề - Tính - viết axit chất hoá sản học của phẩm axit khi cho hỗn hợp 2 kim loại phản ứng với axit - Áp dụng tính chất hoá học của axit vào thực tế 3 1.2 2 0,8 5 2.0 - Phân Hiện loại bazơ, tượng 3. Chủ đề tính chất TN về bazơ hoá học TCHH của bazơ của bazơ - Viết phương trình 2 giai đoạn của bazo 2 0.8 2 0,8 4 1.6 Tính Nhận Tính chất, biết chất 4. Chủ đề ứng muối, hóa muối dụng học của của muối muối 2 0.8 1 0,4 1 2,0 3 1.2 1 2,0 5. Phân - Tìm tên Phân bón hoá phân bón bón hóa học hoá học học 1 0,4 1 1,0 1 0,4 1 1,0 6. Mối Mối quan hệ quan giữa các hệ loại hợp giữa chất vô các cơ hcvc 1 1,0 Tổng 10 4,0 5 2.0 1 1,0 1 2,0 1 1,0 15 6,0 3 4,0 40% 30% 20% 10% 60% 40% UBND HUYỆN AN LÃO ĐỀ KIỂM TRA GIỮA HỌC KÌ I TRƯỜNG THCS TRƯỜNG SƠN Năm học 2022-2023- MÔN: Hóa học 9 Thời gian: 45 phút Họ và tên học sinh: .; Lớp: SBD: Điểm Lời phê của giáo viên I. Trắc nghiệm (6 điểm) Câu 1: Chất nào sau đây là oxit axit? A. SO2 . B. Na2O. C. CaO. D. MgO Câu 2. HCl phản ứng được với dãy chất nào dưới đây? A.K2S, BaO, Cu, NaOH B.HNO3, KOH, CaCO3, Fe C. H2O, SO2, HCl, CaO D. NaOH, BaO, Ca, Na2CO3 Câu 3. Công thức hóa học của đạm ure là: A. CO(NH2)2 B. NH4Cl C. KCl D. NH4NO3 Câu 4. Dung dịch làm đổi màu quỳ tím thành đỏ? A. Na2SO4 B. HCl C. Ca(OH)2 D. NaCl Câu 5. Sản phẩm của phản ứng phân huỷ Cu(OH)2 là : A. CuO và H2 B. Cu v à H2O C. CuO và H2O D. Cu ; H2 v à O2 Câu 6. Dãy nào gồm các oxit đều phản ứng được với nước ở nhiệt độ thường A. SO2 , CaO , Na2O B. P2O5 , MgO, Na2O C. CuO, Cao, K2O D. Na2O, SO3 , FeO Câu 7: Chất nào sau đây không tác dụng với dung dịch H2SO4 lo·ng ? A. Cu B. Zn C. Mg D. Fe Câu 8: Chất rắn tan trong được trong dung dịch HCl là: A. Ag B. Mg C. Cu D. P2O5 Câu 9. Cặp chất nào sau đây không thể tồn tại trong cùng một dung dịch( phản ứng với nhau)? A. KCl và AgNO3 B. CuCl2 và Mg(NO3)2 C. K2SO4 và H2SO4 D. BaCl2 và KOH. Câu 10. Hoà tan hỗn hợp gồm Fe và Cu vào dung dịch HCl (vừa đủ). Các sản phẩm thu được sau phản ứng là: A. FeCl2, CuCl2 và khí H2 B. FeCl2, Cu và khí H2 C. FeCl2 và khí H2 D. FeCl2 và Cu Câu 11: Cho từ từ dd NaOH vào dd FeCl 3, lọc lấy kết tủa nung đến khối lượng không đổi, chất rắn thu được là: A. Fe(OH)2 B. Fe2O3 C.FeO D. Fe3O4 Câu 12. Nhỏ vài giọt dung dịch NaOH vào ống nghiệm chứa dung dịch CuSO4 , hiện tượng quan sát được là: A. Tạo thành chất rắn màu đỏ B. Xuất hiện kết tủa nâu đỏ C. Xuất hiện kết tủa màu xanh D. Có khí không màu thoát ra Câu 13. Hãy chỉ ra bazơ nào là bazơ không tan trong các bazơ sau? A. NaOH. B. Ba(OH)2. C. KOH. D. Cu(OH)2. Câu 14. Để xử lí nước thải, khử chua đất trồng người ta dùng chất nào sau đây? A. KCl B. CO(NH2)2 C. Ca(OH)2 D. NH4NO3 Câu 15. Thuốc thử để nhận biết 2 dung dịch NaCl, Na2SO4 đựng trong 2 lọ riêng biệt bị mất nhãn là: A. Quỳ tím B. dung dịch NaOH. C. dung dịch BaCl2 D.dung dịch HCl II. Tự luận (4 điểm) Bài 1. (1,0 điểm): Viết các phương trình hóa học hoàn thành dãy chuyển đổi chất sau (1) (2) (3) (4) CuO CuSO4 CuCl2 Cu(OH)2 CuO Bài 2.(2,0 điểm): Cho 15,4 g hỗn hợp 2 kim loại Mg và Zn vào 500ml dung dịch HCl vừa đủ người ta thu được 6,72 lít khí (đktc) a. Viết các phương trình phản ứng xảy ra. b. Tính thành phần phần trăm các chất rắn trong hỗn hợp đầu c. Tính nồng độ mol/lit của dung dịch axit đã dùng d. Cho hỗn hợp kim loại ở trên tác dụng với V (ml) dung dịch H2SO4 đặc 10% ( D H2SO4 = 1,12g/ml). Xác định V? Bài 3 (1 điểm): Tại sao khi bị đau dạ dày thường có hiện tượng ợ chua? Để chữa đau dạ dày nhẹ có thể dụng thuốc muối( Natri hidrocacbonat - NaHCO3). Em hãy giải thích và viết PTHH (Cho biết Mg=24; Zn = 65, S =32; O = 16, H =1) Bài làm C. ĐÁP ÁN-BIỂU ĐIỂM I. Trắc nghiệm (6điểm): Chọn đúng mỗi đáp án được 0,4 điểm Câu 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 Đáp án A D A B C A A B A B B C D C C II. Tự luận(4 điểm) Bài 1 (1,5 đ): Xác định đúng mỗi cặp chất phản ứng với nhau và viết đúng PTHH được 0,5 điểm. Các cặp chất PƯ Phương trình hóa học a. Na2CO3 và HCl Na2CO3 + 2HCl 2NaCl + CO2 + H2O c. KCl và AgNO3 KCl + AgNO3 AgCl + KNO3 d. Cu(OH)2 và HCl Cu(OH)2 + 2HCl CuCl2 + 2H2O e.CuSO4 và Ba(OH)2 CuSO4 + Ba(OH)2 Cu(OH)2 + BaSO4 Bài 3 (2 đ) Các bước Điểm PTHH: CuCl2 + 2NaOH Cu(OH)2 + 2NaCl 0,5 1,35 Số mol CuCl2 : n 0,01mol CuCl2 135 0,5 a. Theo PT : n n 0,01mol 0,25 Cu(OH )2 CuCl2 Khối lượng kết tủa Cu(OH) tạo thành là: m = 0,02 . 98 = 1,96 (g) 0.25 2 Cu(OH )2 b.Theo PT : n 2n = 2 . 0,01 = 0,04 mol 0,25 NaOH CuCl2 0,04 Nồng độ mol của dd NaOH đã dùng: C = 2M M 0,02 0,25 Bài 4( 1 đ). Nội dung Điểm - Đau dạ dày thường có hiện tượng ợ chua vì trong dịch vị của dạ 0,5 dày có chứa dung dịch axit HCl. Người bị đau dạ dày là người có nồng độ dung dịch axit HCl cao nên thường có hiện tượng ợ chua,dạ dày bị viêm loét. - Để chữa đau dạ dày nhẹ có thể dụng thuốc muối( Natri 0,25 hidrocacbonat - NaHCO3). Vì NaHCO3 có thể tác dụng với HCl làm giảm hàm lượng của HCl có trong dạ dày. NaHCO3 + HCl -> NaCl + H2O + CO2 0,25 ------- HẾT------ Bổ sung Câu 1 - Viết đúng mối PTHH 0,25đ 1đ /1 PT - Trình bày nhận biết đúng Câu 2 - Viết đúng PTHH 0,75đ 1,0 đ 0,25đ
File đính kèm:
 de_kiem_tra_giua_hoc_ki_i_hoa_hoc_9_nam_hoc_2022_2023_truong.docx
de_kiem_tra_giua_hoc_ki_i_hoa_hoc_9_nam_hoc_2022_2023_truong.docx